Lý thuyết hoá cơ học thật nhiều nên là phần bài bác tập dượt cũng tương đối đa dạng và phong phú. Để những em thực hiện đảm bảo chất lượng những dạng bài bác tập dượt phần hóa cơ học, Kiến Guru hỗ trợ cho những em Các công thức hoá học tập lớp 11 để canh ty giải thời gian nhanh vấn đề hiđrocabon. Bạn đang xem: Các Công Thức Hoá Học Lớp 11 Giúp Giải Nhanh Toán Hiđrocabon

I. Các công thức hoá học tập lớp 11: Toán nhen cháy Hidrocacbon
- Công thức tổng quát mắng của một hiđrocabon (HC): CxHy (x, hắn vẹn toàn dương) hoặc
CnH2n + 2 -2k với k là số links π và vòng nhập hiđrocabon.
- Công thức tính số π + v: π + v = 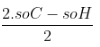
- Phương trình nhen cháy: 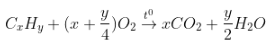
- Dựa nhập số mol CO2 và H2O sau phản xạ tớ rất có thể xác lập được loại thích hợp hóa học.
|
Quan hệ mol CO2 và H2O |
Loại hiđrocabon |
Phương trình |
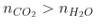 |
Ankan |
|
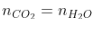 |
Anken |
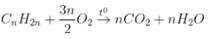 |
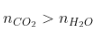 |
Ankin, Ankađien |
|
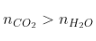 |
Đồng đẳng benzen |
|
- Các lăm le luật bảo toàn thông thường sử dụng:
+ Báo toàn khối lượng: 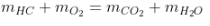
+ Báo toàn vẹn toàn tố:
|
Bảo toàn C: |
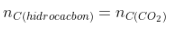 |
|
Bảo toàn H: |
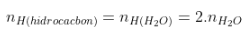 |
|
Bảo toàn O: |
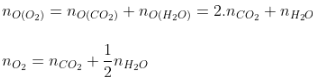 |
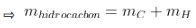 (trong bộ phận phân tử chỉ chứ C và H).
(trong bộ phận phân tử chỉ chứ C và H).
- Công thức tính số C, số H:
+ Số C = 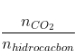
+ Số H = 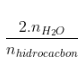
- Đối với những vấn đề nhen cháy láo lếu thích hợp 2 hiđrocabon thì:
+ Khối lượng mol trung bình: 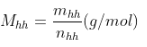
hoặc 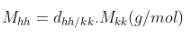 hoặc
hoặc 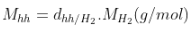
+ Số Ctb = 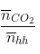
Lưu ý: Khi số C khoảng là số vẹn toàn (bằng khoảng nằm trong của 2 số vẹn toàn tử C) thì số mol 2 hóa học cân nhau.
- Bài toán dùng láo lếu thích hợp thành phầm nhằm kế tiếp mang lại nhập cuộc phản ứng:
+ Dẫn thành phầm cháy qua quýt bình (1) đựng P2O5, H2SO4 quánh, CaO, muối bột khan,.... rồi dẫn qua quýt bình 2 đựng hỗn hợp bazơ như NaOH, Ca(OH)2,...
mbình 1 tăng = mH2O (hấp thụ nước)
mbình 2 tăng = mCO2 (hấp thụ CO2).
+ Dẫn toàn cỗ thành phầm cháy trải qua bình đựng hỗn hợp bazơ như NaOH, Ca(OH)2,...
mbình tăng = mCO2 + mH20 (hấp thụ cả CO2 và nước).
+ Khối lượng hỗn hợp tăng: m dd tăng = mCO2 + mH20 – m kết tủa .
+ Khối lượng hỗn hợp giảm: m dd giảm = m kết tủa – (mCO2 + mH20 ).
+ Lọc quăng quật kết tủa, đung rét hỗn hợp lại chiếm được kết tủa nữa:
PT: 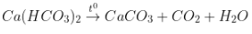
Các công thức hoá học tập lớp 11
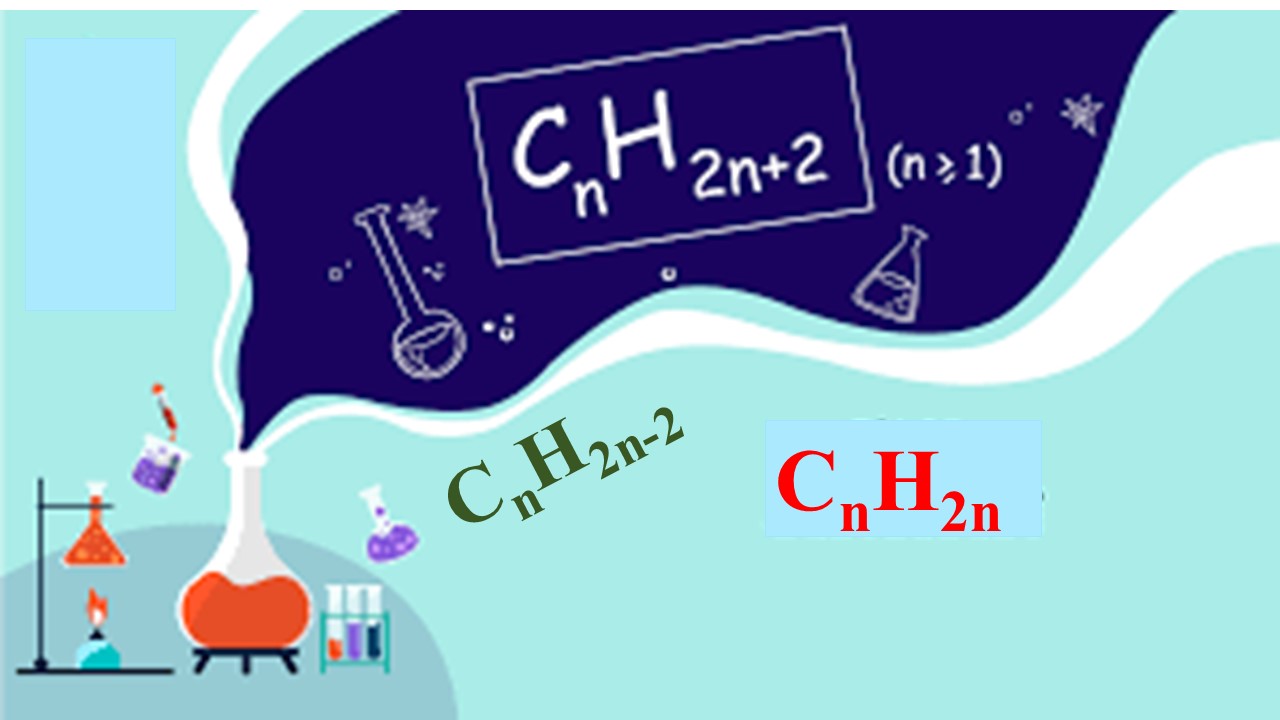
II. Các công thức hoá học tập lớp 11: Tính số đồng phân Hidrocacbon
1. Đồng phân ankan:
- CTTQ: CnH2n+2 (n ≥ 1)
- Ankan chỉ mất đồng phân mạch cacbon và kể từ C4 trở cút mới nhất với đồng phân.
- Công thức tính nhanh: 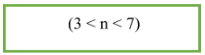
2. Đồng phân anken:
- CTTQ: CnH2n (n ≥ 2).
- Anken với đồng phân mạch C, đồng phân địa điểm nối song và đồng phân hình học tập.
- Mẹo tính thời gian nhanh đồng phân anken:
Xét 2C đem nối song, từng C tiếp tục links với 2 group thế (giống hoặc không giống nhau).
Ví dụ với C4H8: Trừ cút 2C đem nối song sẽ vẫn 2C và H group thế.
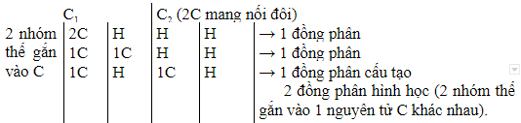
Nếu đề bài bác đòi hỏi tính đồng phân cấu trúc tiếp tục là: 1+1+1=3 đồng phân. Nếu đòi hỏi tính đồng phân (bao bao gồm đồng phân hình học) được xem là 1+1+2=4 đồng phân.
3. Đồng phân ankin:
- CTTQ: CnH2n-2 (n ≥ 2).
- Ankin với đồng phân mạch C, đồng phân địa điểm nối tía và không tồn tại đồng phân hình học tập.
- Mẹo tính thời gian nhanh đồng phân ankin:
Xét 2C đem nối tía, từng C tiếp tục links với cùng 1 group thế (giống hoặc không giống nhau).
Ví dụ với C4H6: Trừ cút 2C đem nối tía sẽ vẫn 2C và H là group thế.
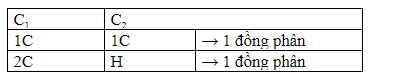
Ta với 2 đồng phân ankin.
4. Đồng phân benzen:
- CTTQ: CnH2n-6 (n ≥ 6).
- Công thức tính số đồng phân: 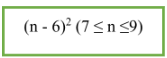
5. Đồng phân ancol:
- CTTQ của ancol no, đơn chức, mạch hở: CnH2n+1OH hoặc CnH2n+2O (n ≥ 1).
- Ancol với đồng phân mạch C và đồng phân địa điểm group OH.
- Công thức tính số đồng phân: 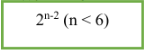
6. Đồng phân ete:
- CTTQ của ete no, đơn chức, mạch hở: CnH2n+2O (n ≥ 2).
- Công thức tính số đồng phân: 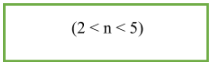
7. Đồng phân phenol:
- CTTQ: CnH2n-6O (n ≥ 6)
- Công thức tính nhanh: 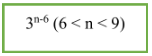
8. Đồng phân anđehit:
- CTTQ của anđehit no, đơn chức, mạch hở: CnH2nO (n ≥ 1). Trong phân tử có một nối song ở group chức CHO.
- Công thức tính nhanh: 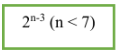
9. Đồng phân xeton:
- CTTQ của xeton no, đơn chức, mạch hở: CnH2nO (n ≥ 3). Trong phân tử chứ một nối song ở group chức CO.
- Công thức tính số đồng phân: 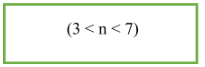
10. Đồng phân axit:
- CTTQ của axit no, đơn chức, mạch hở: CnH2nO2 (n ≥ 1). Trong phân tử có một nối song ở group chức COOH.
- Công thức tính số đồng phân: 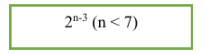
III. Các công thức hoá học tập lớp 11: Phản ứng thế Halogen
- Đây là phản xạ đặc thù của ankan.
1. Dẫn xuất monohalogen:
- Ankan + Halogen tỉ lệ thành phần 1 : 1 chiếm được dẫn xuất monohalogen.
Xem thêm: Vé máy bay từ Cần Thơ đi Đà Lạt 2024 từ 199.000đ
- Yêu cầu của đề: xác lập công thức ankan
- PT: 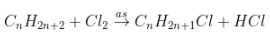
hoặc 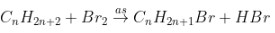
- Dữ kiện: đề bài bác tiếp tục mang lại %C, %H, hoặc %Halogen.
- Công thức tính:
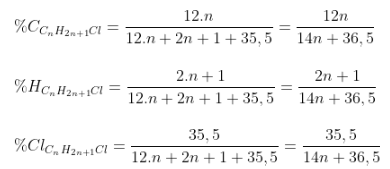
Kết phù hợp với dữ khiếu nại đề mang lại, thám thính n.
- Sau Khi xác lập được CTPT, nhờ vào con số thành phầm thế nhằm thám thính CTCT của ankan. Khi phản xạ với halogen mang lại thành phầm độc nhất, ankan được xem là ankan đối xứng.
2. Dẫn xuất khẩu, tri...halogen:
- Ankan + Halogen tỉ lệ thành phần 1 : 2, 1 : 3, ...
- Yêu cầu của đề: xác lập công thức của dẫn xuất halogen.
- Dữ kiện: đề bài bác tiếp tục mang lại %C, %H, hoặc %Halogen và CTPT của ankan.
- PT:
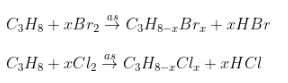
- Công thức tính: (ví dụ với ankan là C3H8)
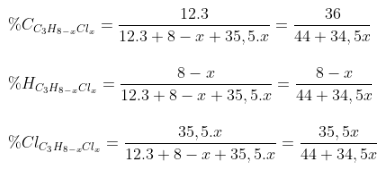
Xác lăm le x.
IV. Các công thức hoá học tập lớp 11: Phản ứng cracking
- Phương trình:
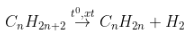
Ankan Anken
hoặc 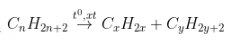 (x + hắn = n)
(x + hắn = n)
Anken Ankan khác
Ví dụ:
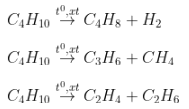
- Từ ankan đầu, sau phản xạ rất có thể thu nhiều hóa học thành phầm.
- Khối lượng láo lếu thích hợp trước và sau phản xạ ko đổi:
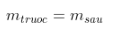
=> 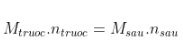 hoặc
hoặc 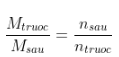
- Báo toàn nhân tố C và H: Khi đề bài bác mang lại nhen cháy láo lếu thích hợp sau phản xạ tớ qui về nhen cháy láo lếu thích hợp trước phản xạ (một hóa học tiếp tục rất đơn giản chất).
- Số mol láo lếu hợp: 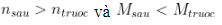
Ví dụ: 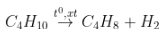
1 1 1
=> 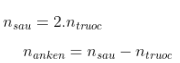
- Hiệu suất phản ứng: 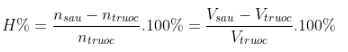
(Các công thức tương quan cho tới số mol tớ rất có thể thay cho thế bởi vì thể tích).
- Phản ứng nằm trong đánh tan links π. Liên kết π là links kết tầm thường bền, nên bọn chúng dễ dẫn đến đứt rời khỏi sẽ tạo trở thành links những vẹn toàn tử không giống.
1. Cộng H2:
- Chất xúc tác như: Ni, Pt, Pd, ở sức nóng chừng tương thích.
- Sơ đồ:
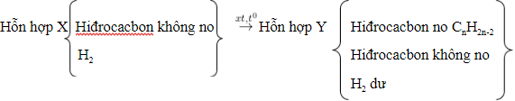
- PTTQ: 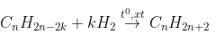
Với k là số links π nhập phân tử, 1π tiếp tục cùng theo với 1H2.
- Tùy nhập hiệu suất và tỉ lệ thành phần của phản xạ nhưng mà láo lếu thích hợp Y rất có thể còn hiđrocacbon ko no dư hoặc hiđro dư hoặc cả nhị còn dư.
- Trong phản xạ nằm trong H2, số mol khí sau phản xạ luôn luôn hạn chế (nY < nX) và bởi vì mol H2 phản ứng: 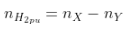
- Báo toàn khối lượng: 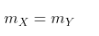
- 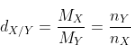 (luôn to hơn 1).
(luôn to hơn 1).
- Hỗn thích hợp X và Y chỉ thay cho thay đổi về hóa học vẫn bảo toàn H và C, nên thay cho nhen cháy Y tớ rất có thể nhen cháy X. Sử dụng lăm le luật bảo toàn nhân tố như vấn đề nhen cháy.
- 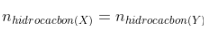
a) Xét hiđrocacbon X là anken:
- Sơ đồ:
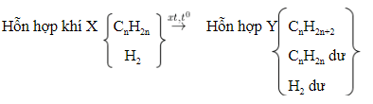
- Phương trình:
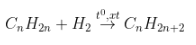
- 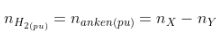 (= số mol khí giảm).
(= số mol khí giảm).
b) Xét hiđrocacbon X là anken:
- Sơ đồ:
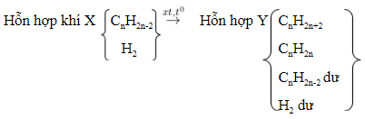
- Phương trình tổng quát:
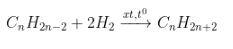
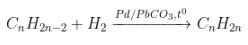
- 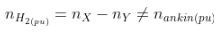
2. Cộng brom:
- Phương trình:
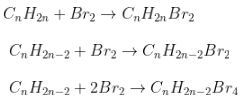
- Công thức:
+ m bình tăng = m hiđrocacbon ko no
+ Vkhí bay ra = V hiđrocacbon no
+ nπ = 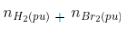
VI. Các công thức hoá học tập lớp 11: Bài tập dượt về phản xạ của ankin với links tía đầu mạch với hỗn hợp AgNO3/NH3
- Phản ứng xẩy ra chỉ với ankin với nối tía đầu mạch (ank – 1 – in).
- PTTQ:
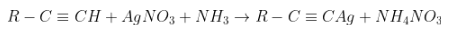
Kết tủa vàng
Phản ứng với tỉ lệ thành phần 1:1
- Riêng với axetilen:
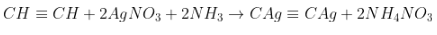
Phản ứng với tỉ lệ thành phần 1:2.
- Gọi 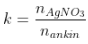 ,
,
+ k = 1: láo lếu thích hợp chỉ bao gồm ank – 1 – in,
+ 1 < k < 2, láo lếu thích hợp bao gồm C2H2 (hoặc ankin với 2 nối tía đầu mạch) và ank – 1 – in.
- Mkết tủa = Mankin + 107x (với x là số nối tía đầu mạch).
Xem thêm: Vé giá rẻ từ Thành phố Hồ Chí Minh đi Tuy Hòa có giá từ 1.939.553 ₫
Các công thức hoá học tập lớp 11
Nếu nắm rõ được những phản xạ và Các công thức hoá học tập lớp 11 trên phía trên, những em tiếp tục giải được những dạng bài bác tập dượt về hiđrocacbon. Hãy rèn luyện và áp dụng thiệt nhiều những em nhé!
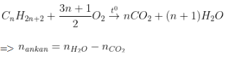
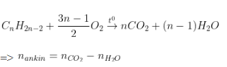
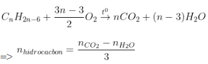








![[Quan trọng] Thủ tục và giá vé cho trẻ em đi máy bay Vietnam Airlines - BestPrice](https://owa.bestprice.vn/images/articles/uploads/quan-trong-thu-tuc-cho-tre-em-di-may-bay-vietnam-airlines-5e90344f7ee65.jpg)


Bình luận