Ôn tập dượt môn Hóa học tập 8
Công thức tính bộ phận Xác Suất theo gót lượng và thể tích được công ty chúng tôi thuế tầm và tổng phải chăng thuyết vô công tác giảng dạy dỗ môn Hóa học tập lớp 8. Hi vọng rằng trên đây được xem là những tư liệu hữu ích vô công tác làm việc giảng dạy dỗ và học hành của quý thầy cô và chúng ta học viên.
Bạn đang xem: Công thức tính thành phần phần trăm theo khối lượng và thể tích - Ôn tập môn Hóa học 8
Lưu ý: Nếu mình thích Tải bài xích viết này về PC hoặc điện thoại thông minh, vui sướng lòng kéo xuống cuối nội dung bài viết.
I. Nồng chừng là gì?
Nồng chừng là định nghĩa nhằm biểu thị lượng hóa hóa học sở hữu vô một láo hợp ý, phần nhiều là hỗn hợp. Một số định nghĩa mật độ hoặc bắt gặp là:
- Nồng chừng phần trăm
- Nồng chừng mol
- Nồng chừng molan: Biểu thị số mol của một hóa học mang đến trước vô 1kg dung môi
- Nồng chừng chuẩn: Thường người sử dụng mang đến những phản xạ và hỗn hợp axit – bazo
- Nồng chừng chủ yếu tắc: Là cơ hội đo mật độ tương tự động như mật độ mol và hiếm hoi khi dùng
II. Nồng chừng Xác Suất là gì?
Nồng chừng Xác Suất biểu thị số gam hóa học tan sở hữu vô 100g hỗn hợp và được ký hiệu là C%.
1. Công thức tính mật độ Xác Suất C% theo gót lượng
Phần trăm lượng là gì?
- Phần trăm lượng tiếp tục cho thấy tỷ trọng Xác Suất của từng nhân tố vô hợp ý Hóa chất.
- Muốn dò xét Xác Suất lượng, tớ cần phải biết lượng mol của những nhân tố vô hợp ý hóa học theo gót gam/mol hoặc số gam của những hóa học tạo ra trở thành hỗn hợp.
- Phần trăm lượng được xem với 1 công thức giản dị và đơn giản, này là lấy lượng của nhân tố (hay hóa học tan) phân tách mang đến lượng của hợp ý hóa học (hay dung dịch).
Phần trăm theo gót lượng (m / m) là lượng hóa học tan phân tách mang đến tổng lượng của hỗn hợp, nhân với 100%.
Phần trăm theo gót lượng = lượng hóa học tan/tổng lượng hỗn hợp ×100%
Công thức tính C% vô hóa học:
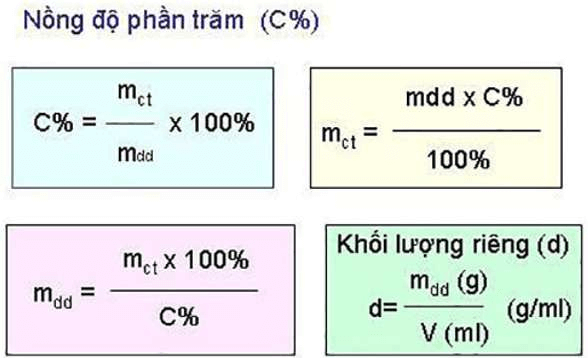
Trong đó:
- C%: Ký hiệu của mật độ phần trăm
- mct: Ký hiệu của lượng hóa học tan
- mdd: Ký hiệu của lượng dung dịch
Công thức tính mdd:
mdd = mct + mdm (trong bại mdm là lượng của dung môi)
Ví dụ
Phần trăm lượng của hỗn hợp chứa chấp 26,5 g glucose vô 500 g hỗn hợp là bao nhiêu?
Dung dịch
Phần trăm theo gót lượng = lượng glucose/tổng lượng dung dịch×100% = 26,5g
500g × 100% = 5,30%
2. Công thức tính mật độ Xác Suất C% theo gót thể tích
- Phần trăm theo gót thể tích (v / v) là thể tích hóa học tan phân tách mang đến tổng thể tích hỗn hợp, nhân với 100%.
- Phần trăm theo gót lượng = thể tích hóa học tan/tổng thể tích hỗn hợp × 100%
Ví dụ
Làm thế này các bạn sẽ sẵn sàng 250 ml 70% (v / v) rượu xát
Dung dịch
70% = thể tích rượu cồn xát/tổng thể tích hỗn hợp ×100% × 100%
Vì thế
Thể tích rượu cồn xát = thể tích hỗn hợp × 70%/100% = 250 ml × 70/100= 175 ml
Bạn tiếp tục tăng đầy đủ nước vô 175 ml rượu xát sẽ tạo đi ra tổng số 250 ml hỗn hợp.
III. Các bước giải bài xích thói quen mật độ phần trăm
Các dạng bài xích thói quen mật độ Xác Suất vô chất hóa học đặc biệt nhiều mẫu mã, tuy nhiên bọn chúng đều cần triển khai giải theo gót quá trình sau đây:
- Cách 1: Khi hiểu đề bài xích tất cả chúng ta rất cần được xác lập được số hóa học sở hữu vô hỗn hợp, nhất là những số dư của hóa học nhập cuộc phản xạ.
- Cách 2: Tính lượng hỗn hợp sau khoản thời gian nhập cuộc phản xạ theo gót cách thức bảo toàn lượng (tổng lượng hóa học nhập cuộc phản xạ = tổng lượng sản phẩm).
- Cách 3: Tính mct
- Cách 4: sát dụng công thức tính mật độ Xác Suất nhằm xử lý câu hỏi.
Áp dụng chính 4 bước bên trên đấy là chúng ta trọn vẹn rất có thể tính mật độ Xác Suất rồi. Tuy nhiên, có rất nhiều bài xích tập dượt nó ko mang đến sẵn lượng của những hóa học nên tớ rất cần được vận dụng những kỹ năng và kiến thức chất hóa học và được học tập kết phù hợp với công thức tính mật độ Xác Suất nhằm giải câu hỏi nhé.
Xem thêm: Đặt vé máy bay Tết 2025 Ất Tỵ giá rẻ online
Bài thói quen mật độ Xác Suất của hỗn hợp
Bài 1: quý khách hàng hãy tính lượng của NaOH sở hữu vô 200g hỗn hợp NaOH 15%
Lời giải:
Áp dụng công thức C% = (mct/mdd).100% tớ có:
C% = (mNaOH/200).100 = 15 (%)
=> mNaOH = (15.200)/100 = 30 (g)
Trong đó:
- (.) ký hiệu lốt nhân
- (/) ký hiệu lốt chia
Kết luận: Vậy vô 200g hỗn hợp NaOH 15% sở hữu 30 gam NaOH
Bài 2: Tiến hành hòa tan đôi mươi gam muối bột vô nước nhận được hỗn hợp A sở hữu C% = 10%
a, Hãy tính lượng của hỗn hợp A thu được
b, Hãy tính lượng nước quan trọng cho việc trộn chế
Lời giải:
a, sát dụng công thức C% = (mct/mdd).100% tớ có:
mdd =(mmuối.100)/ C% = (20.100)/10 = 200 gam
Kết luận: Vậy lượng hỗn hợp A là 200 gam
b, sát dụng cách thức bảo toàn lượng tớ sở hữu mnước = mdd - mmuối = 200 - đôi mươi = 180 gam
Kết luận: Vậy nhằm rất có thể trả tan đôi mươi gam muối bột thì tất cả chúng ta cần cần thiết 180 gam nước sẽ tạo đi ra 200 gam dung dịch
Bài 3: Tiến hành hòa tan 3,9 gam Kali vô 36,2 gam nước tất cả chúng ta nhận được hỗn hợp B sở hữu mật độ bao nhiêu?
Lời giải:
Ta sở hữu phương trình phản xạ chất hóa học sau
2K + 2H2O → 2KOH + H2
Số mol của K = 3,9/ 39 = 0,1 => mol KOH = 0,1 => mol H2O = 0,05
Theo thăng bằng phương trình tớ tính được:
mdd = mk + mH2O - mH2 = 3,9 + 36,2 - (0,05.2) = 40 gam
=> sát dụng công thức C% = (mct/mdd).100% tớ sở hữu C% = [(0,1.56)/40].100% = 14%
Kết luận: Khi tổ chức hòa tan 3,9 gam Kali vô 36,2 gam nước đi ra tiếp tục nhận được hỗn hợp sở hữu mật độ 14%.
IV. Một số Note khi tính mật độ Xác Suất của dung dịch
- Phải hiểu đề kĩ nhằm hiểu rằng đúng chuẩn những bộ phận đang được mang đến, xác lập được cần thiết đo lường và tính toán những bộ phận này.
- sát dụng chính công thức tính nhằm tách những sai lầm không mong muốn ko quan trọng.
- Tính những tài liệu cần cẩn trọng, tách những sơ sót ko xứng đáng sở hữu.
V. Nồng chừng mol không giống mật độ Xác Suất như vậy nào?
Nồng chừng Mol là gì?
Nồng chừng mol của hỗn hợp mang đến tất cả chúng ta biết số mol hóa học tan sở hữu trong một lít hỗn hợp là từng nào.
1. Công thức tính mật độ mol theo gót khối lượng
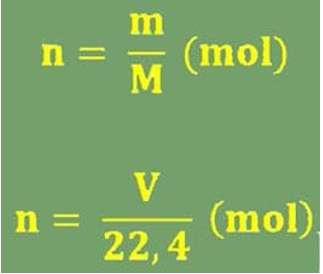
Trong đó:
- n: ký hiệu số mol
- m: lượng của hóa học đó
- M: Khối lượng mol của hóa học bại (có sẵn vô bảng tuần trả hóa học)
- V: Thể tích (đktc)
2. Cách tính mật độ mol
Nồng chừng mol sở hữu ký hiệu là CM và được xem theo gót công thức
C M = n/V dd
- CM: ký hiệu của mật độ mol
- n: Ký hiệu số mol hóa học tan
- Vdd: Ký hiệu thể tích dung dịch
VI. Mối mối quan hệ đằm thắm mật độ Xác Suất và những mật độ hỗn hợp khác
Giữa mật độ Xác Suất và mật độ mol
C M = (10 x d x C%) / M
Trong đó:
- M: lượng phân tử hóa học tan.
- CM: mật độ mol của hỗn hợp.
- d: lượng riêng rẽ của hỗn hợp.
- C%: mật độ Xác Suất của hỗn hợp.
Giữa mật độ Xác Suất và mật độ đương lượng
C N = (10 x d x C%) / D
Xem thêm: Vẽ Bầu Trời Mây cơ bản - Hướng dẫn dành cho người mới bắt đầu
Trong đó:
- D: đương lượng gam
- d: lượng riêng rẽ của hỗn hợp.
- CN: mật độ tương tự của dung dịch
- C%: mật độ Xác Suất của hỗn hợp.
-------------------------------------------
Như vậy VnDoc đang được ra mắt chúng ta tư liệu Công thức tính bộ phận Xác Suất theo gót lượng và thể tích. Mời chúng ta xem thêm tăng tài liệu: Chuyên đề Hóa học tập 8, Giải bài xích tập dượt Hóa học tập 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học tập 8, Tài liệu học hành lớp 8








![[Quan trọng] Thủ tục và giá vé cho trẻ em đi máy bay Vietnam Airlines - BestPrice](https://owa.bestprice.vn/images/articles/uploads/quan-trong-thu-tuc-cho-tre-em-di-may-bay-vietnam-airlines-5e90344f7ee65.jpg)



Bình luận